DEFINICIÓN:
Un mecanismo no puede ser probado, el debe satisfacer todos los hechos experimentales y puede ser anulado con la aparición de nuevos hechos.
Existen reacciones que suceden por mecanismos diferentes bajo diferentes condiciones.
Existen también casos donde más de un mecanismo es capaz de describir todos los hechos experimentales.
Tipos de mecanismos
a) Mecanismo Heterolítico
Para la mayoría de las reacciones es conveniente denominar los reactivos como:
- Reactivo atacante
- Sustrato
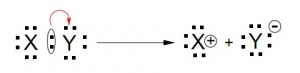
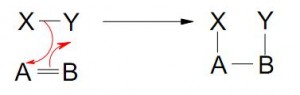
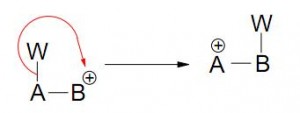
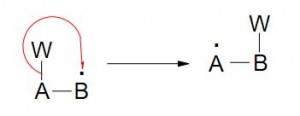
Reactivo: Puede “traer” el par de electrones hacia el sustrato (nucleófilo) o “tomar” un par de electrones de el (electrófilo)
- Reacción nucleofílica – (Reactivo nucleofilo)
- Reacción electrofílica – (Reactivo electrófilo)
Cuando la molécula del sustrato se rompe:
- La parte que no contienen carbono es el grupo que “abandona” (nucleófilo o electrófilo)
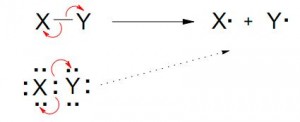
b) Mecanismo Homolítico (A través de radicales libres)
c) Mecanismo Pericíclico
Los electrones se trasladan sin la formación de iones o radicales
Tipos de Reacción:
La mayoría de las reacciones pueden ser encuadradas en una de las seis categorías:
i- SUSTITUCIONES (3 posibilidades)
- Nucleofílica (Heterolítica)
Atrae el par de electrones hacia el sustrato
- Eletrofílica (Heterolítica)
Toma su par de electrones desde el sustrato
- Vía radicales libres (Homolítica)
Transferencia de cadena
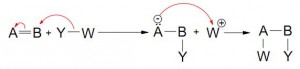
ii- ADICIONES A DOBLES O TRIPLES ENLACES ( 4 posibilidades)
- Adición electrofílica (Heterolítica)
- Adición nucleofílica (Heterolítica)
- Adición a través de radicales libres (Homolítica)
- Adición Simultánea
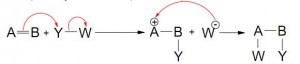
La mayor parte de los esquemas muestra Y-W rompiéndose al mismo tiempo en que Y se enlaza a B. Esto raramente sucede, a no ser en el caso de reacciones pericíclicas.
iii- ELIMINACIÓN BETA (β)
Estas reacciones pueden suceder por mecanismo heterolítico o pericíclico (vía radicales libres son raras).
- W y X pueden salir o no de forma simultánea
- Pueden combinarse o no
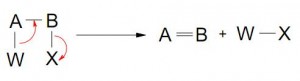
iv- REORDENAMIENTOS
Pueden involucrar migración de 1 átomo o grupo de un átomo hacia otro.
- Migración con 1 par de electrones (nucleofílica)
- Migración con 1 electrón (radical libre)
Los esquemas muestran reordenamientos del tipo en que el migrante se mueve hacia el átomo vecino (más comunes). Sin embargo, pueden suceder también reordenamientos para átomos más distantes.
Existen reordenamientos que no involucran migraciones simples. Algunos involucran mecanismos pericíclicos.
v- OXIDACIÓN Y REDUCCIÓN
Muchas reacciones de oxidación y reducción encuadran en uno de los cuatro tipos ya citados y muchas otras no.
i- COMBINACIÓN DE LOS TIPOS YA CITADOS
OBSERVACIONES:
Las flechas utilizadas son empleadas para mostrar el movimiento de los electrones. Más allá que sean utilizadas en reacciones pericíclicas por comodidad, no se sabe realmente en que dirección los electrones se están moviendo.
SUSTITUCIÓN NUCLEOFÍLICA
Las reacciones de sustitución se constituyen en uno de los tipos más comunes entre los encontrados en la química orgánica.
Sustituciones nucleofílicas en el carbono saturado
Los más comunes son los mecanismos SN1 y SN2
Difieren entre si en el proceso de formación de un nuevo enlace y rutpura del anterior.
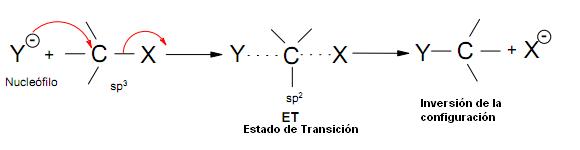
Mecanismo SN2 (Mecanismo de 1 etapa)
El nucleofilo atacante se aproxima del sustrato a 180 grados del grupo de salida
- En el ET (estado de transición) Y y X están parciamente mezclados con el orbital p, aproximadamente en posición perpendicular al orbital sp2.
- En el ET los 3 sustituyentes y el C central son aproximadamente coplanarios.
Existen muchas evidencias experimentales para este mecanismo.
La formación de un nuevo enlace ocurre simultáneamente con la rotura del antiguo.
REACCIONES POR RADICALES:
Son reacciones en las que intervienen radicales, generalmente como estados intermedios, como por ejemplo la halogenación radicalaria de alcanos.
Las reacciones en las que intervienen radicales libres se llaman reacciones radicalarias. Se dividen normalmente en tres fases: iniciación, propagacióny terminación.
La reacción global de sustitución mostrada en la ecuación 1 se puede descomponer en los siguientes procesos:
Reacciones de iniciación:
Son las reacciones que producen un aumento en el número de radicales libres.
- La ecuación 2 corresponde a una ruptura homopolar provocada por termólisis o fotólisis.
- La ecuación 3 corresponde a una ruptura favorecida por un radical iniciador Init·
Reacciones de propagación:
Se producen reacciones entre radicales. Corresponde a las etapas 4 y 5.
Reacciones de terminación:
Finalmente, se recombinan los radicales para formar moléculas más estables. Corresponde a las etapas 6 y 7.
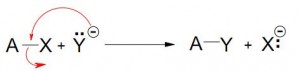
REACCIONES IÓNICAS:
Las reacciones ionicas se efectúan debido a la atracción entre cargas negativas y cargas positivas de distintos grupos funcionales en las moléculas.
http://books.google.com.mx/En estas reacciones polares o heterolíticas, la electronegatividad tiene mucha importancia. Se sabe que un átomo de carbono unido a un elemento más electronegativo que él, le confiere una carga parcial positiva. A la inversa, si está unido a un átomo menos electronegativo que él, induce en el carbono una carga parcial negativa.
Al ser este carbono parte de una molécula, lo convierte en un centro de reacción.
Si este centro es negativo o parcialmente negativo, será atacado entonces por reactivos ávidos de electrones o Electrófilos.
Electrófilos: Son todas aquellas especies capaces de aceptar electrones de otra especie química llamada Nucleófilo, pudiendo formar entonces un enlace entre ellas.
Ejemplo de Electrófilos
H+, H+3O, HX (X = halógenos), HNO3, HNO2, H2SO4, ( etc, todos los ácidos
orgánicos. F3B, NO+2, SO3, AlCl3, ZnCl2, etc. y los grupos funcionales con
átomos electronegativos que inducen polarización de enlaces donde el polo
positivo del dipolo, actúa como centro deficiente de electrones.
Por otro lado, lo contrario sucede con centros de reacción con carga parcial positivo. Este centro atraerá partículas ricas en electrones o nucleófilos.
Nucleófilos: Son las especies químicas que muestran afinidad por los sitios de baja densidad electrónica llamados electrófilos, con el cual es capaz de formar enlace.
Puede verse que los nucleófilos son especies cargadas negativamente o especies sin carga, pero con electrones no compartidos.


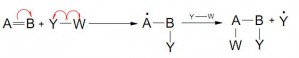

No hay comentarios:
Publicar un comentario